第四军医大学口腔医学院领面外科 – 贺福长, 毛天球, 李德伦, 吴军正, 贾宝军
西北上业大学 – 邹光荣, 唐卫, 姜战军
〔摘要〕 利用稀土永磁体磁片形成 0.25T 的恒定强磁场, 观察该强度磁场对四种口腔颌面部癌细胞体外培养的影响, 发现对这四种癌细胞均有不同程度抑制作用, 其中两种腺癌细胞比两种鳞癌细胞对磁场更敏感些, 并发现随着磁场作用时间加长, 这种抑制作用更明显. 磁性脂质体被体外培养的癌细胞摄取后将会增强这种抑制作用.
关键词: 磁生物效应; 脂质体; 恒定强磁场; 癌
近年来, 生物磁学的基础研究和应用研究发展迅速, 其中磁场对细胞尤其是肿瘤细胞的生物效应研究尤引人注目, 但目前为止对人的肿瘤细胞研究很少, 对人口腔颌面部恶性肿瘤细胞的研究目前尚未见有报道. 本文拟通过对 0.25T 恒定强磁场对人口腔颌面部四种癌细胞体外培养的影响观察, 希望对恶性肿瘤磁疗学提供有益的参考资料.
1 材料与方法
1.1 癌细胞系采用本院中心实验室建立的传代细胞系即人粘液表皮样癌 MEC-1 系, 腺样囊性癌 SACC-83 系, 舌癌 Tca8113 系及牙齦癌 Ca9-22 系. 培养液采用含 10% 胎牛血清 RPMI-1640 培养液. 磁性脂质体为作者自制, 经电镜和光镜检查, 符合脂质体一般特点. 稀土永磁体磁片, 场强 0.25T.
1.2 磁场对4种口腔颌面部癌细胞的作用
将上述 4 种细胞制备成适当密度的细胞悬液, 以每孔 100µl 如分别接种于 2 块 96 孔培养板, 每种细胞约 18 孔 或 12 孔. 培养 24h 后, 其中一块培养板不加磁场作为对照, 另一块加 0.25T 磁场作为处理, 培养至 5d, 每孔加入10µl MTT溶液, 继续培养 4h, 然后吸除孔内液体, 每孔加人 150µl 二 甲基亚砜 (DMSO), 振荡 5-10min 后, 在微孔比色仪上测定其吸收 (OD值), 波长490nm, 计算 𝑥±𝑠 及抑制率 (%). 按上述同样方法同时观察了 MEC-1 作用 7d 后结果. 在细胞体外培养过程中每天用相差显微镜观察细胞体外生长情况, 并拍摄了相片.
1.3 磁性脂质体对磁场的增强作用
按上述同样方法将 MEC-1 细胞接种于 2 块 96孔培养板, 培养 24h 后, 两块培养板分别加入 100µl 含 PBS 液及磁性脂质体 PBS 液的培养液, 然后其中一块培养板加磁场, 另一块不加磁场, 培养至 7d, 每孔加入 20µl MTT如 溶液, 其余步骤同上.

1.4 MTT (噻唑兰) 试验方法
上述检测磁场对细胞生物学效应采用的是 MTT 试验, 是通过比色测定细胞数量和活性的新的试验方法. 其敏感性同其它经典方法相似, 具有敏感, 简便, 快速, 重复性好等优点 (1,2).
2 实验结果
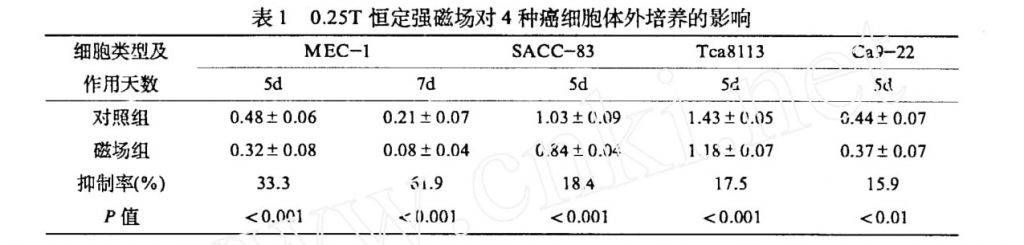
2.1 恒定强磁场对 4 种癌细胞体外培养生长的影响4种癌细胞在 0.25T 磁场下培养至 5d, 其中MEC-1 细胞分别培养至 5d, 7d, 其结果如表 1 所示, 0.25T 磁场对 MEC-1, SACC-83, Tca8113, Ca9-224 种癌细胞作用 5d 时均有不同程度的抑制作用, 抑制率分别为 33.3%, 18.4%, 17.5% 和15.9%, MEC-1 在作用 7d 时, 抑制率提高到 61.9%. 从以上结果可以看出, 同样的磁场强度和作用时间, 不同癌细胞对磁场的敏感性不同, 因此磁场对不同癌细胞抑制作用程度也不同. 另外如场强不变, 作用时间加长, 磁场对癌细胞抑制作用也加强.
2.2 磁比脂质体对磁场的增强作用
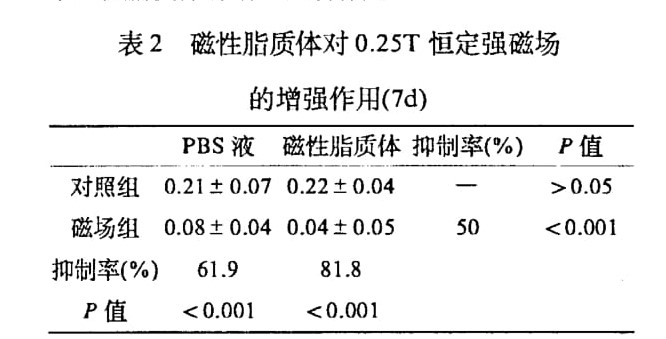
MEC-1 细胞在分组加入 PBS 液及磁性脂质体 PBS 液后在 0.25T 磁场下作用 7d 后结果如表 2 所示, 未加磁场培养板, PBS 液与磁性脂质体 PBS 液培养孔 OD 值经统计学检验 P >0.05, 说明磁性脂质体对体外细胞培养无细胞毒作用, 但是加上磁场后, 磁性脂质体与 PBS 培养孔 OD 值相差非常显著, 抑制率达 50%, 说明磁性脂质体被癌细胞摄取后, 虽本身无细胞毒作用, 但却有增强磁场对癌细胞抑制作用. 两块培养板 PBS 液孔与磁性脂质体 PBS 液孔, 在其中一块培养板加上磁场后, 各自相比抑制率分别为 61.9% 和 81.8%, 同样说明了磁性脂质体有增强磁场作用.
2.3 相差显微镜观察及摄片结果
在细胞培养前 3d, 磁场组与对照组细胞密度, 形态未见明显差别, 第 4d 开始,磁场组中 MEC-1 细胞密度明显少于对照组, 核分裂相少见,死细胞增多; SACC-83 细胞磁场组的细胞密度与对照组相比差别不大, 但死细胞明显增多, 细胞失去正常形态; 而 Tca8113 与 Ca9-22 细胞系镜下差别不明显.
3 讨论
恒定强磁场对癌细胞的抑制作用, 不完全决定于强度, 也取决于磁场作用时间的长 短. Halper 等人 (3) 研究了0.12T 恒定磁场下培养 2d 后 Hela 细胞的生长, 结果表明细胞的生长在磁场内不受影响. 张小云等 (4) 研究了 0.4T 和 0.6T 两种强度磁场下作用 2d 后 Hela 细胞生长,发现存在着差异, 并且 0.6T 磁场下细胞生长受抑制作用明显, 而0.4T 下的作用不明显. 同时证实了磁场对细胞由 S 期进入 G2 期起着延缓作用. 这与 Mulay (5) 的放射自显影研究结果一致, 认为 0.37T 磁场抑制了 S-37 肿瘤细胞 DNA 合成速率; Malinin 等 (6.7) 也同样证实了离体哺乳动物细胞 DNA 合成受到4T 的磁场的抑制; 这与常汉英等 (8) 报道的脉冲磁杨造成 s180 肉瘤活细胞核分裂相数目减少的现象很接近. 本文实验结果表明 0.25T 的恒定强磁场作用 5d 后对 4 种癌细胞均有不同程度抑制作用. 其中 MEC-1, SACC-83 (均属腺癌) 对磁场影响较敏感 (根据抑制率及显微镜下表现), 而 Ca9-22, Tca8113 (均属鳞癌) 对磁场抑制作用敏感程度稍低一些. 由于两类癌细胞生物学表现不同, 尤其是细胞增殖动力学差异, 导致两类癌细胞对恒定强磁场敏感性不同.
同其它辐射生物学效应一样, 磁场作用时间不同将产生不同的效应. 本文实验结果表明, 若磁场作用时间加长, 则抑制作用也将增强, 磁生物效应的实验研究表明, 磁生物效应具有阈值性和时间累积效应, 不同生物层次, 不同类型磁场其阈值不同. 因此磁场疗法中的磁计量应包含两个参量, 即磁场强度 H (均匀磁场) 或磁场梯度 dH/dx (非均匀磁场) 和作用时间 t , 也就是说应把 H.t 或dH/dx.t 作为磁场疗法中磁计量参数, 即磁场作用剂量来表示对生物作用的程度 (单位:10-4 T.h). 这一参数为磁疗在临床中的应用提供了客观尺度.
磁性脂质休是一种包封超微 Fe3O4 微粒10nm, 具有双层或多层单位膜样结构的脂质小囊 (称为“人工细胞”). 它本身无细胞毒作用, 在与癌细胞体外培养过程中, 能被癌细胞十分有效地摄取, 而不会出现细胞毒作用, 但若加上 0.25T 恒定强磁场后, 超微 Fe3O4 便被磁化, 这样一方面相当于增大了细胞内部磁场强度, 导致了磁场梯度的变化, 同时磁化了的 Fe3O4 微粒更直接地干扰了癌细胞的增殖. 因此磁性脂质体将明显增强磁场对癌细胞抑制作用. 详细机理有待进一步探讨.
本文的实验过程中通过相差显微镜观察细胞在磁场下生长情况, 没有发现因磁场作用而使贴壁后癌细胞再脱落现象, 这与张小云等 (4) 实验结果一致. 萧萍等 (9) 用磁性营养液 (0.038T) 培养细胞在外加 0.12T 磁场下发现 Hela 等细胞脱落现象, 很可能是外加磁场作用于磁性液体的结果.
关于强磁场致癌细胞生长缓慢, 文献报道多认为是在磁场作用下 S 相细胞增多并阻断于 G2 期使M相细胞减少, 这与 DNA 合成降低有关 (4-7), 其机理尚不清楚. 一般认为恒定强磁场主要通过对生物体内带电颗粒的洛仑兹力作用和对抗磁各向异性物质的磁转矩作用产生生物效应, 从而导致细胞正常生理功能的改变, 如 DNA 合成速率降低, 微管结构解聚, 某些酶的活性降低, 分布形式改变, 以致细胞不能进入分裂期. 总之, 强磁场抑制肿瘤细胞生长是各种作用综合的结果.